Référence :
Inserm – BPCO
https://inserm.fr/information-en-sante/dossier-informationbronchopneumopathie-chronique-obstructive
Une toux chronique et un essoufflement à ne pas négliger

La broncho-pneumopathie chronique obstructive (ou BPCO) est une maladie chronique inflammatoire des bronches, le plus souvent associée à d’autres maladies. Elle se caractérise par un rétrécissement progressif et une obstruction permanente des voies aériennes et des poumons, entraînant une gêne respiratoire. Les recherches en cours visent en particulier à mieux comprendre les mécanismes de la maladie pour identifier des facteurs de risques et des cibles thérapeutiques.
- 3.5 millions de personnes concernées en France. 17 000 décès en 2017.
- 80% des cas attribuables au tabagisme (actif ou passif).
- La BPCO ne se guérit pas, mais sa prise en charge ralentit son évolution et peut inverser certains symptômes.
Comprendre la BPCO
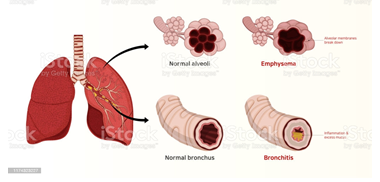
La broncho-pneumopathie chronique obstructive (BPCO) est une maladie chronique respiratoire. Chez les personnes atteintes, une inflammation des voies aériennes (et notamment des bronches) provoque l’épaississement de leurs parois, ainsi qu’une hypersécrétion réactionnelle de mucus. Le tissu pulmonaire est également inflammé, ce qui entraîne des perturbations dans le fonctionnement des cellules qui le constitue. Les alvéoles pulmonaires qui permettent les échanges gazeux lors de la respiration sont progressivement détruites, conduisant à l’emphysème. La broncho-pneumopathie chronique obstructive (BPCO) est une maladie encore relativement méconnue du grand public. Pourtant elle n’est pas rare : en 2010, on estimait à 3.5 millions le nombre de personnes atteintes en France soit 7.5% de la population. Mais ce chiffre est probablement sous-estimé en raison d’une proportion élevée de patients non diagnostiqués. La maladie est plus fréquente chez les fumeurs, le tabac étant le principal facteur de risque. Avec le développement du tabagisme féminin, la BPCO concerne aujourd’hui presque autant de femmes que d’hommes. La fréquence de cette maladie chez les femmes est passée de 28 pour 10 000 en 2006 à 41 pour 10 000 en 2015.

En 2015 environ 150 000 personnes atteintes de formes sévères de la maladie et âgées de plus de 45 ans bénéficiaient d’une oxygénothérapie de longue durée associée ou non à un traitement par ventilation. La BPCO entraîne en outre chaque année de nombreuses hospitalisations et de décès liés aux exacerbations de la maladie (i.e. les poussées d’aggravation des symptômes habituels). Les taux d’hospitalisation augmentent régulièrement depuis 2000, avec une certaine hétérogénéité entre les régions. En 2017, entre 107 000 et 170 000 séjours hospitaliers en lien avec la BPCO ont été comptabilisées en France et 17 000 décès étaient imputables à la maladie comme cause initiale ou associée.
La mortalité associée à la maladie stagne malgré les progrès de la prise en charge, probablement en raison d’un sous-diagnostic de la maladie ou de diagnostics trop tardifs. Selon les projections de l’OMS, La BPCO pourrait constituer la 3ème cause de mortalité dans le monde en 2030.
Le tabac, premier coupable.

Le principal facteur de risque de BPCO est le tabagisme (actif ou passif) : plus de 80% des cas lui sont attribuables.
Cependant d’autres facteurs accroissent également le risque de développer la maladie :

- La pollution de l’air intérieur ou extérieur.
- Les expositions professionnelles ou domestiques à des poussières et des substances chimiques (silice poussière de charbon, poussières végétales, moisissures).
- Le tabagisme passif in utero.
- Des infections des voies respiratoires inférieures fréquentes au cours de l’enfance peuvent aussi créer un terrain propice au développement ultérieur de la BPCO.
- Et comme toute maladie multifactorielle, une composante génétique existe également.
Les métiers à risque de BPCO

Les travailleurs du secteur minier sont à risque en cas d’exposition à la silice, de travaux au fond des mines de charbon ou de fer et d’inhalation de poussières ou fumées d’oxyde de fer. Les métiers du bâtiment et travaux publics sont concernés en cas de creusement des tunnels d’asphaltage des routes ou encore en cas d’exposition chronique et/ou à des niveaux excessifs de gaz, de poussières et de vapeurs. Un risque de BPCO est également documenté dans les secteurs de la fonderie et de la sidérurgie en cas d’exposition à plusieurs particules minérales (poussières métalliques charbon, silice) à des gaz ou des fumées (émissions des fours, fumées métalliques oxyde de soufre ou d’azote). Dans l’industrie du textile, ce sont les employés de filature de coton, lin, chanvre ou sisal qui sont exposés. Quant aux métiers agricoles et d’élevage, plusieurs sont concernés par ce risque : ouvriers travaillant dans des silos dans la production laitière, l’élevage de porcs ou de volailles ou encore en cas d’utilisation de pesticides.
Symptômes et diagnostic.

La BPCO se manifeste par des signes cliniques non spécifiques : Toux chronique, expectorations, essoufflement (dyspnée). Ces symptômes sont souvent sous-estimés par les patients. Ils apparaissent progressivement, de façon insidieuse et s’aggravent avec le temps en augmentant la dyspnée. Certaines activités quotidiennes deviennent de plus en plus difficiles à réaliser et l’activité physique décroit, parfois de façon très importante.
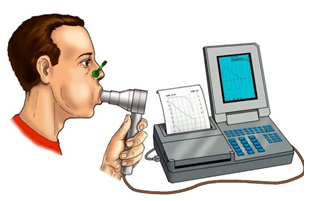
Cette dégradation progressive est ponctuée d’exacerbations, c’est-à-dire d’épisodes d’aggravation de la toux de l’expectoration et de la dyspnée. Ces épisodes peuvent nécessiter des consultations non programmées ou des hospitalisations. Face à des symptômes persistants de ce type, en particulier chez un sujet fumeur ou exposé à un facteur favorisant, une spirométrie est nécessaire : c’est le seul moyen de diagnostiquer une obstruction bronchique. Il s’agit d’un test permettant de mesurer les volumes pulmonaires et les débits bronchiques du patient. Il consiste à réaliser des manœuvres respiratoires, En particulier lors de l’expiration, à travers un embout buccal relié à un dispositif de mesure des volumes et débits (spiromètre). Plus les voies aériennes sont obstruées plus le volume d’air expiré est faible : ainsi la mesure du volume maximal expiratoire en 1 seconde (VEMS) est un indicateur de la sévérité de l’obstruction bronchique. La maladie est confirmée si le VEMS du patient, rapporté son plus grand volume pulmonaire mobilisable, est diminué malgré l’inhalation d’un bronchodilatateur de courte durée d’action.
Le résultat du VEMS post-bronchodilatateur permet de classer la maladie selon le degré de sévérité de l’obstruction bronchique :
- Stade I : léger, VEMS supérieur ou égale à 80%
- Stade II : modéré, VEMS comprise entre 50 et 80%
- Stade III : sévère, VEMS comprise entre 30 et 50%
- Stade IV : Très sévère, VEMS inférieur à 30%

Cette classification a évolué en intégrant la sévérité de la dyspnée d’effort (la gêne respiratoire à l’effort), l’altération de la qualité de vie et le nombre d’exacerbations dans l’année, conduisant à la définition des stades A à D de la maladie. Des index composites prenant en compte, en plus de l’obstruction et la dyspnée des paramètres nutritionnels et la tolérance à l’exercice (capacité et acceptabilité à faire de l’exercice), sont également très utiles dans le suivi des patients.
Le « comorbidome »
La BPCO est une maladie chronique associée à de nombreux autres troubles : on parle de comorbidités.
Ces comorbidités peuvent affecter différents organes et des fonctions diverses : métaboliques musculaires, cardiaques, gastro-intestinales, psychiques (anxiété, dépression)…En moyenne, un patient de BPCO présente cinq comorbidités.
De travaux récents ont permis de passer en revue 7 comorbidités observées chez les patients et de montrer que douze d’entre elles constituent des facteurs de mauvais pronostic et accroissent le risque de décès dans les 5 années suivantes : cancer du poumon, du pancréas, de l’œsophage ou encore du sein, fibrose pulmonaire, fibrillation auriculaire, insuffisance cardiaque, maladie coronarienne, ulcères gastroduodénaux, cirrhose hépatique, diabète avec neuropathie et anxiété. D’ailleurs, la plupart des patients ne décèdent pas d’insuffisance respiratoire mais d’accidents cardiovasculaires, de pneumonies de cancer…
La dysfonction des muscles squelettiques, en particulier ceux des membres inférieures est aussi une comorbidité qui représente un facteur de mauvais pronostic indépendant des autres atteintes.
Les liens entre BPCO et les comorbidités reposent très certainement sur des mécanismes inflammatoires, des stresses oxydatifs et l’altération des voies de signalisation communes à différentes fonctions de l’organisme. Ces liens sont à l’étude.
Traitements
La BPCO ne peut être guérie, mais sa prise en charge ralentit son évolution et peut même inverser certains symptômes. Cette prise en charge est multidisciplinaire. Elle inclut :
- L’arrêt du tabac
- Des médicaments
- Une réhabilitation respiratoire
- De l’exercice physique

Après un diagnostic de BPCO la première mesure consiste à arrêter de fumer et/ou à interrompre l’exposition aux substances favorisant la maladie. La prise en charge médicamenteuse repose sur l’utilisation de bronchodilatateurs de courte ou de longue durée d’action, permettant de dilater les voies respiratoires et d’améliorer le débit d’air. Ce traitement peut être associé à des corticoïdes pour réduire l’inflammation locale en cas d’exacerbations répétées et de symptômes importants.

Dans les formes les plus sévères entraînant une insuffisance respiratoire chronique, une oxygénothérapie de longue durée est nécessaire. Elle doit être administrée au moins 15h par jour pour améliorer la survie. Elle peut être complétée par une ventilation, non invasive.

La réhabilitation respiratoire est utile pour tous les patients présentant une intolérance à l’effort et des limitations dans leurs activités quotidiennes, en général dès le stade II de sévérité de la maladie. Elle repose sur une approche multi et transdisciplinaire, incluant exercice musculaire (endurance et renforcement des muscles périphériques équilibre, posture), éducation thérapeutique (sevrage tabagique, observance thérapeutique, méthodes de prise des traitements inhalés, équilibre nutritionnel, gestions des exacerbations…) et kinésithérapie respiratoire. Une activité physique régulière et adaptée apparaît donc comme primordiale pour freiner l’évolution de la maladie.

La réhabilitation respiratoire préconisée par un pneumologue, se fait en générale sur une période de 6 à 7 semaines. Durant cette période le patient retrouve de l’autonomie grâce au développement de sa masse musculaire qui permet d’améliorer sa respiration. Ensuite il est fortement conseillé de continuer ces activités chez soi, chez un kinésithérapeute ou dans une association d’anciens patients. Tout arrêt prématuré de l’activité de réhabilitation, entraîne une perte des acquis de ce stage Il est important de marcher tous les jours environ 0h30.

La vaccination antigrippale est recommandée chaque année aux patients atteints de BPCO. Une vaccination antipneumococcique est également conseillée aux patients en insuffisance respiratoire chronique tous les 5 ans.
Les enjeux de la recherche.
Mieux comprendre les facteurs de risques et les mécanismes en jeu.

Le tabac est à l’origine d’environ 80% des cas de BPCO mais d’autres facteurs de risque ont été identifiés comme la pollution extérieure et intérieure (notamment associée à la combustion de certains bois). Ces polluants induisent des lésions et une inflammation au niveau des bronches et du tissu pulmonaire différente de celle observée en cas d’asthme et impliquant des mécanismes distincts. Les scientifiques s’attèlent à décrire ces voies pour identifier de nouvelles cibles thérapeutiques.
Ils étudient en outre la vulnérabilité individuelle à la BPCO : Pourquoi environ 20% des fumeurs développent une BPCO et pas les autres ? Qu’est-ce qui protège ces derniers au niveau broncho-pulmonaire ? Pourquoi certains sujets atteints de BPCO ne répondent pas aux traitements comme l’activité physique ? Des cohortes comme COBRA (Cohorte Obstruction Bronchique et Asthme) dédiée à la recherche de marqueurs prédictifs de l’asthme et de la BPCO, favorisent ce travail.
Clarifier les liens entre la BPCO et ses comorbidités.

Les comorbidités associées à la BPCO ont en commun des mécanismes inflammatoires ou un stress oxydatif. Des voies de signalisation communes à ces différentes pathologies doivent pouvoir expliquer ces associations. Elles font probablement intervenir des molécules comme des cytokines pro-inflammatoires ou des protéines de dégradation cellulaire. Les chercheurs s’intéressent notamment à l’association entre BPCO, baisse de l’activité physique et perte musculaire. Des travaux ont en effet prouvé que la réduction d’activité physique est un facteur de mauvais pronostic associé au déclin de la fonction pulmonaire, à une inflammation « généralisée » et à une augmentation du risque d’hospitalisation et de décès.

En outre, en plus d’une faiblesse des muscles périphériques, les patients présentent des anomalies musculaires (atrophie, altération du métabolisme musculaire), notamment au niveau des membres inférieurs. Ces anomalies qui accroissent les difficultés à l’effort pourraient découler des effets systématiques (qui affectent l’ensemble de l’organisme) de la maladie. Elles sont particulièrement importantes chez les patients les moins résistants à l’effort et sont associées à un risque accru de mortalité précoce.
Comprendre la diversité des manifestations cliniques.
Non seulement les personnes exposées de la même façon au tabagisme ont un risque différent de développer une BPCO mais, s’ils en développent une, ils présenteront probablement des symptômes variables. Les chercheurs tentent de comprendre cette variabilité en étudiant ses déterminants (facteurs de risques, susceptibilités génétiques…) mais aussi en travaillant sur l’origine de l’atteinte pulmonaire à un stade très précoce, dès le stade embryonnaire. En effet, la fonction pulmonaire est maximale à l’âge de 20-25 ans puis elle décline plus ou moins rapidement selon les risques auxquels la personne est exposée. Des anomalies de développement précoce peuvent altérer la fonction pulmonaire et la vitesse du déclin. Ainsi, les prématurés et nourrissons présentant un petit poids à la naissance ont non seulement une fonction pulmonaire maximale plus faible que les nourrissons nés à terme en bonne santé, mais ils ont aussi un risque accru de BPCO.
L’exposition in utero à des polluants ou encore le tabagisme maternel, serait à l’origine de ces atteintes précoces qui ne se manifestent qu’à l’âge adulte.
Vers une médecine personnalisée de la BPCO.
On ne parlera bientôt plus de la BPCO mais de différents sous-types de BPCO. L’analyse des symptômes et de la biologie des patients permet en effet aux chercheurs de découvrir des spécificités dans la maladie. Dans les années à venir les données disponibles pourraient conduire à la définition de différents groupes de malades, notamment en fonction des caractéristiques de la maladie, de leurs comorbidités et de leur réponse aux traitements. Dans l’objectif, des « bio-marqueurs » spécifiques des sous-types de BPCO sont recherchés dans des cohortes spécifiquement constituées. Cette « classification » permettrait de proposer des traitements plus personnalisés.
De récents travaux ont par exemple montré que la persistance de l’inflammation systémique n’est pas une constante de la maladie : environ 30% des patients dont l’état de santé est stable ne présentent pas d’inflammation systémique, environ 50% des patients ont une inflammation systémique intermittente et environ 16% des patients présentent une inflammation systémique persistante. Cette dernière est un facteur de mauvais pronostic qui accroit le risque de comorbidités, notamment cardiovasculaires. Ces différences pourraient être prises en compte pour personnaliser davantage les traitements.
L’utilisation d’innovations technologiques et organisationnelles (téléconsultation, télésurveillance, télé-réhabilitation) et d’objets connectés (saturomètres, spiromètres, podomètres…) constitue des approches en plein développement pour le suivi et la prise en charge personnalisée de cette maladie.
Pronostic et problèmes en phase terminale.
En elle-même la BPCO ne cause généralement pas le décès ou de symptômes graves, si la personne cesse de fumer à un moment où le flux d’air est seulement légèrement obstrué. La poursuite du tabagisme rend cependant pratiquement certaine l’aggravation des symptômes. En cas d’obstruction modérée ou grave du débit aérien, le pronostic s’aggrave progressivement.
Les personnes à un stade avancé de BPCO nécessitent le plus souvent des soins cliniques lourds et doivent être aidées dans l’accomplissement des activités de la vie quotidienne. Elles peuvent, par exemple, prendre des dispositions pour vivre sur un seul étage de leur maison, prendre plusieurs petits repas chaque jour au lieu d’un grand repas et éviter de porter des chaussures à lacets.
La mort peut être la conséquence d’une insuffisance respiratoire, d’un cancer du poumon, de troubles cardiaques (par exemple, insuffisance cardiaque ou anomalies du rythme cardiaque), d’une pneumonie, d’un pneumothorax ou de thromboses des artères pulmonaires (embolie pulmonaire).

Les personnes au stade terminal peuvent nécessiter une intubation et une ventilation mécanique en cas d’exacerbation. La durée de ventilation mécanique peut être longue et certaines personnes deviennent dépendantes du respirateur jusqu’à leur décès. Il est important avant qu’une exacerbation ne se produise, que les personnes concernées discutent avec leur médecin et leurs proches de leur souhait de se soumettre ou non à ce type de traitement palliatif.
L’alternative à ce traitement palliatif est un traitement de confort (qui ne vise pas à prolonger la vie). La meilleure façon pour une personne de s’assurer que ses souhaits sont respectés en ce qui concerne la ventilation mécanique prolongée est de préparer ses directives préalables et de donner pouvoir à un membre du corps médical pour prendre les décisions à sa place.
Directives Anticipées : SRLF (Société de Réanimation de langue Française)
Recherche internet : SRLF formulaire directives anticipées
Formulaire des directives anticipées :
https://www.srlf.org/wp-content/uploads/2018/01/2018-SRLF_formulaire-directives_anticipees.pdf

