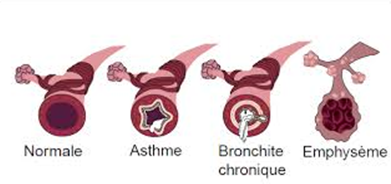
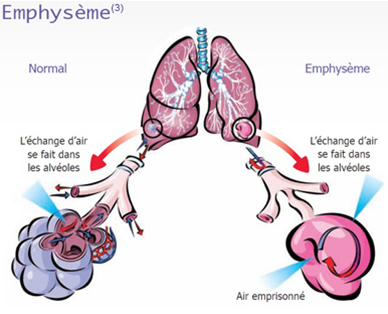
L’emphysème pulmonaire correspond à une destruction des espaces aériens situés en dessous des bronchioles terminales. Les parois des alvéoles sont détruites ce qui entraîne la formation de « bulles » au sein du poumon. C’est le stade ultime et irréversible de la broncho-pneumopathie chronique obstructive (BPCO).

L’emphysème pulmonaire est caractérisé par une augmentation de la taille des alvéoles pulmonaires situées au-delà des petites bronches. Les parois où se font les échanges entre l’air et le sang, perdent leur élasticité, ce qui aboutit à leur destruction : de nouvelles entités, les « bulles » prennent leur place mais elles ne permettent pas une oxygénation du sang correcte. La respiration devient difficile.
L’emphysème est souvent associé à la catégorie des BPCO (ou MPOC). A l’imagerie, on distingue quatre types d’emphysème :
- Centrolobulaire ou central atteignant le centre des lobules secondaires,
- Panlobulaire atteignant la totalité du lobe secondaire
- Paracicatriciel au décours de lésion pulmonaire
- Paraseptal qui est sous-pleural
Il est difficile de savoir exactement combien de français sont concernés par l’emphysème puisque les chiffres dont on dispose ne font pas de véritable distinction entre la BPCO, la bronchite chronique et l’emphysème. Mais globalement, 2.5 millions de français seraient atteints de l’une de ces trois affections (dont 500 000 femmes) et près de 30 000 décès leur seraient imputables chaque année.
Quelle origine ?
La destruction d’une substance essentielle de la structure des alvéoles – l’élastine – est à l’origine de l’emphysème. L’élastine, substance élastique constituant les parois des alvéoles, est essentielle au bon fonctionnement des poumons et à la réalisation des échanges entre l’air et le sang.
Plusieurs facteurs peuvent conduire à l’emphysème : en premier lieu une sensibilité génétique liée à un déficit en alpha 1-antitrypsine (substance qui lutte habituellement contre l’enzyme élastase qui tend à détruire les parois des alvéoles). Cette maladie générique est rare.
La plupart des emphysèmes sont en rapport avec une inflammation des parois alvéolaires due à l’inflammation des bronches liée à la bronchite chronique. L’inflammation s’associe, en effet, à un afflux de globules blancs (les neutrophiles) chargés en élastase, l’enzyme qui détruit l’élastine des alvéoles. Certaines pneumopathies, la tuberculose et toutes les autres pathologies à l’origine de cicatrices pulmonaires peuvent entrainer des lésions d’emphysème.
Qu’est-ce que je ressens ?

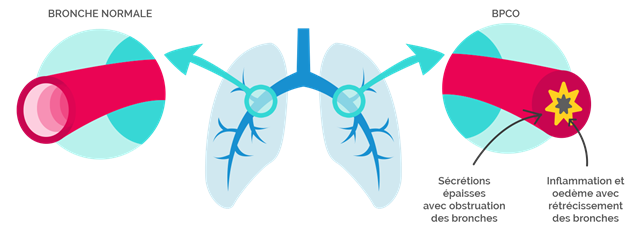
L’emphysème est, le plus souvent, l’évolution d’une bronchite chronique.
Le diagnostic de bronchite chronique est évoqué devant l’existence d’une toux intermittente, quotidienne. Les expectorations sont nombreuses. Les difficultés respiratoires sont progressives, persistantes et aggravées par les efforts ou les infections.
Au stade de l’emphysème les efforts sont, en général, limités. La personne a du mal à dormir à plat dos. La respiration se fait les lèvres pincées et le temps expiratoire est plus long. Les difficultés respiratoires peuvent même exister au repos.
D’autres signes cliniques sont présents comme une cyanose (coloration bleue des extrémités et des lèvres), un hippocratisme digital (ongles bombés et aspect élargi des dernières phalanges). Le thorax est bombé, comme distendu et les côtes sont horizontales
Quelle évolution ?
En l’absence de prise en charge efficace du facteur favorisant (le tabac), l’emphysème évolue progressivement vers une insuffisance respiratoire. Et parfois, même lorsque le sevrage tabagique est effectué, l’emphysème gagne en intensité et la fonction respiratoire décline. Cette évolution, qui se fait progressivement, peut être associée à des épisodes de décompensation brutale liée à une infection bronchique ou pulmonaire. Ces épisodes infectieux entraînent une décompensation respiratoire, autrement dit une poussée d’insuffisance respiratoire aiguë qui peut être fatale. En moyenne, le nombre d’exacerbations est compris entre 2 et 3 par an quand la maladie est évoluée.
L’insuffisance respiratoire devient rapidement chronique en cas d’emphysème et des épisodes de décompensation aiguë rythment l’évolution. L’emphysème correspond à des lésions irréversibles.
Physiopathologie
Dans la respiration normale l’air est aspiré à travers les bronches et dans les alvéoles, qui sont de petits sacs entourés par les capillaires. L’oxygène et le CO2 passent les parois des alvéoles et se transfèrent dans le sang et dans l’air alvéolaire respectivement. Lorsque les substances toxiques telles que la fumée de cigarette, sont inhalées dans les poumons les particules nocives sont piégées dans les alvéoles, provoquant une réponse inflammatoire localisée.
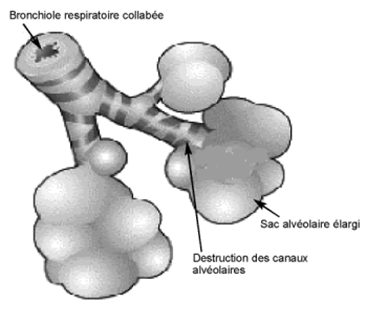
Les produits chimiques libérés lors de la réponse inflammatoire (par exemple, élastase) peuvent éventuellement provoquer la désintégration du septum alvéolaire. Cette condition, connue sous le nom de rupture septale, conduit à des déformations importantes de l’architecture pulmonaire qui sont responsables de la plupart des manifestations cliniques. L’événement clé mécanique consécutif à la rupture septale est que la cavité qui en résulte est plus grande que la somme des deux espaces alvéolaires.
En effet, en raison du manque de soutien mécanique du septale rompu, le recul élastique des poumons élargit encore ce nouvel espace nécessairement au détriment du parenchyme sain et environnant. En d’autres termes, comme conséquence immédiate et spontanée de la rupture septale, la force élastique du poumon rééquilibre l’expansion du parenchyme sain à un niveau inférieur en proportion de la quantité de ruptures septales.

Les grandes cavités laissées par la rupture septale sont connues comme des « bulles ». Ces déformations causent une forte diminution de la superficie utilisée pour les échanges gazeux des alvéoles ainsi que de la ventilation du parenchyme sain environnant. Il en résulte un facteur de transfert diminué du monoxyde de carbone par le poumon (TLCO). Pour répondre à la diminution de surface, l’expansion de la cage thoracique (thorax en tonneau) et la contraction du diaphragme (aplatissement) ont lieu. L’expiration qui physiologiquement dépend entièrement du recul élastique du poumon, dépend de plus en plus de la cage thoracique et de l’action des muscles abdominaux en particulier dans la phase expiratoire. Du fait d’une ventilation diminuée, la capacité à exsuder le dioxyde de carbone est compromise de manière significative.
Dans les cas les plus graves, l’absorption d’oxygène est également réduite. Comme les alvéoles continuent de se dégrader, l’hyperventilation est incapable de compenser la diminution progressive de surface et le corps n’est pas capable de maintenir des niveaux élevés d’oxygène dans le sang. Le dernier recours du corps est la vasoconstriction des vaisseaux appropriés. Cela conduit à l’hypertension pulmonaire, ce qui place une pression accrue sur le côté droit du cœur, le côté responsable du pompage du sang désoxygéné vers les poumons. Le muscle cardiaque s’épaissit afin de pomper plus de sang. Cette condition est souvent accompagnée par l’apparition d’une distension veineuse jugulaire. Finalement, comme le cœur continue à échouer, de plus en plus de sang s’accumule dans le foie.
Les patients soufrant d’une maladie génétique appelée Alpha 1-antitrypsin deficiency (ou A1AD) n’ont presque plus d’alpha 1-antitrypsine. (Alpha 1-antitrypsine ou a1-antitrypsine (A1AT) est un inhibiteur de la sérine protéase (serpine). Elle protège les tissus contre les enzymes produites par des cellules inflammatoires, particulièrement l’élastase. On la trouve dans le sang humain à des taux de 0.9 à 1.5 grammes/litre).
Cette protéine inhibe des enzymes inflammatoires telles que l’élastase qui détruisent le tissu alvéolaire. Néanmoins le tabagisme peut lui aussi causer l’emphysème. Le type d’emphysème causé par l’A1AD est connu comme emphysème panlobulaire (impliquant l’ensemble du acinus), par opposition à l’emphysème centrolobulaire, qui est causé par le tabagisme. L’emphysème panlobulaire affecte généralement les poumons inférieurs, tandis que l’emphysème centrolobulaire affecte les poumons supérieurs. L’A1AD est la cause d’environ 2% des emphysèmes. La plupart des porteurs de la mutation A1AD ne développent pas les symptômes cliniques d’emphysème, mais le tabagisme et une baisse drastique des niveaux d’A1AT (10-15%) peuvent déclencher la maladie. L’emphysème léger peut se développer en une forme sévère en peu de temps (1-2 semaines).
La maladie générique A1AD fournit un aperçu de la pathogenèse de la maladie même si le manque héréditaire d’A1AT n’est qu’assez rarement responsable de l’emphysème. Lors du siècle dernier, la plus grande partie des études se sont concentrées sur le rôle supposé de l’élastase leucocytaire (ou élastase neutrophile), une protéase sérique trouvée dans les neutrophiles, comme principale responsable dans la destruction des tissus conjonctifs observé dans la maladie. Cette hypothèse qui vient de l’observation faite de l’A1AT qui se lie principalement à cette élastase neutrophile et qu’elle en est la principale inhibitrice, est connue comme la théorie « protéase-antiprotéase ». Cette théorie pose donc que les neutrophiles sont des médiateurs importants de la maladie. Néanmoins des études plus récentes ont mis en lumière la possibilité que d’autres protéases, spécialement certaines métalloprotéases matricielles, sont autant voire plus impliquées que l’élastase neutrophile dans le développement de l’emphysème non-héréditaire.
Ces dernières décennies les recherches sur la pathogenèse de l’emphysème se faisaient sur les animaux. On injectait différentes protéases dans la trachée de plusieurs espèces d’animaux. Ces animaux souffraient alors d’une destruction des tissus conjonctifs, ce qui était pris comme une confirmation de la théorie des protéases-antiprotéases. Néanmoins, il n’est pas possible d’établir un lien de causalité entre la maladie et la destruction des tissus conjonctifs du poumon par ces substances. Des expériences plus récentes et plus pointues technologiquement tentent des approches différentes impliquant par exemple des manipulations génétiques.
Etiologie
Les deux plus grandes causes de l’emphysème pulmonaire sont :
- Le tabagisme ou l’enfument des habitations chauffées au bois. (Grandes majorité des cas et donnant surtout des emphysèmes centrolobulaires et paraseptaux)
- Déficience en alpha 1-antitrypsine d’origine génétique (très rare) donnant des emphysèmes panlobulaires
Manifestations cliniques

La dyspnée d’effort (gêne respiratoire) est le seul symptôme. La pâleur et la fatigue sont parfois associées à la dyspnée. Le thorax est distendu (en forme de tonneau), la respiration rapide et superficielle, l’expiration prolongée. A l’auscultation, le médecin peut entendre des râles bronchiques. Souvent caractéristique d’une BPCO, l’emphysème s’accompagne souvent d’un profil typique maigre, longiligne, de coloration rose, avec des voies aériennes peu ou pas encombrées.
Examens diagnostiques

- Exploration fonctionnelle respiratoire (EFR)
- Epreuves de fonction pulmonaire
- Radiographie pulmonaire
- Scanner pulmonaire (ou tomodensitométrie) La radiographie n’est pas suffisante dans certains cas, surtout en dépistage.
- Gaz artériel ou gaz du sang (vérification de l’échange gazeux).
Traitement

L’emphysème est une lésion définitive (pas de traitement curatif) mais des traitements symptomatiques (ou prévenant l’aggravation) existent :
- Arrêt du tabagisme s’il existe (le plus important des traitements).
- Bronchodilatateurs d’action prolongée en cas de trouble ventilatoire obstructif confirmé. (Salbutamol)
- Antibiotiques en cas d’infections des voies respiratoires. (Amoxicilline)
- Vaccination antigrippale et anti-pneumococcique.
- Traitement à base d’anti-inflammatoires stéroïdiens (glucocorticoïdes) en cas d’inflammation.
- Kinésithérapie respiratoire. Oxygénation artificielle, partielle (à l’effort) ou complète (24h/24).

- Utilisation de la VNI (ventilation non invasive) pour un meilleur échange gazeux.
- Réentraînement à l’effort.
- Parfois, chirurgie de réduction de volume dans certains emphysèmes bulleux respectant des zones ventilatoires « récupérables ». D’autres techniques d’exclusions peuvent être employées ou sont en cours de test avec de bons résultats sur des cas sélectionnés : valve endo ronchique ou dispositifs obstructifs.
- Parfois, transplantation pulmonaire (mono-pulmonaire, bi-pulmonaire ou cœur-poumon).
Pharmacologique

La plus grande partie de la médication aide les patients atteints d’emphysème à mieux respirer lorsqu’ils pratiquent une activité physique. Les médicaments aident à dilater les bronches, soulager l’essoufflement, diminuer l’inflammation et permettre un meilleur transfère d’oxygène. Il existe une thérapie d’augmentation de l’alpha-antitrypsine appelée prolastine qui est dérivée du plasma humain et administrée une fois par semaine par injection intraveineuse ; Ce traitement est encore à l’étude et est très onéreux mais il semblerait aider les patients à être moins essoufflés à l’exercice et aussi à ralentir la progression de la maladie. Les bronchodilatateurs à courte durée d’action sont utilisés au besoin pour viser un soulagement immédiat, principalement les béta2-agonistes. Les anticholinergiques et les méthhylxanthines sont désormais moins utilisés en raison d’un rapport bénéfices/risques moins avantageux à cause d’effets secondaires et d’interactions médicamenteuses. Les bronchodilatateurs à longue durée d’action (formoterol, béta2 agoniste), bromure de tiotropium, bromure d’ipratropium (anticholinergiques) sont utilisés plus régulièrement.

